



本文授权转载自微信公众号:
细胞王国,ID:cell-kingdom
提到移植,无论是器官移植,还是细胞移植,“配型”一直是个备受人关注的字眼。人们常说,配型犹如大海捞针,异常困难,以骨髓造血干细胞移植为例,配型成功率在几万至几十万分之一不等。
而如今,医学界又提出胎盘、脐带间充质干细胞使用无需配型的说法,这所谓的“配型”,究竟指的是什么?这里,根据掌握的数据和资料,为大家简单介绍下干细胞移植时的一些配型相关知识。
什么是配型
配型,又称组织配型,核心为HLA分型匹配。HLA 是Human Leukocyte Antigen 的简拼,即“人类白细胞抗原”,广泛分布于机体内几乎所有有核细胞的表面。
每个人的 HLA 千差万别,因此,HLA 又有人体生物学的“身份证”之称。它是不同个体免疫细胞相互识别的标志,机体“区分敌我、识别自身、排除异已”的主要遗传标记,参不免疫应答反应,具有非常重要的生物学功能。
因此在进行细胞移植时,供受者之间的 HLA 匹配程度反映了供受双方的组织相容性程度,和移植手术后的排斥反应率密切相关,决定了移植成功或失败,故又将其称为移植抗原。
HLA 是一大类抗原分子的统称,虽然种类繁多,但免疫原性强弱不等,其中,以 HLA-A、HLA-B、HLA-DRB1 的免疫原性最强,不移植排斥反应关系最为密切,因此在干细胞移植配型时,首先对这三种抗原进行基因型匹配。
而编码这三个抗原的基因位于两条同源染色体上,一条来自父方,一条来自母方,因此,共 3×2=6 个位点。这也就产生了我们常听到的“全相合、4 个位点相合、5 个位点相合”这样的说法。
国内外大量的临床研究结果表明,受者和供者之间 HLA 相容程度越高,也就是受者和供者之间 HLA-A、B、DR 六个位点相合匹配的越多,排斥反应的发生率就越低,移植成功率就越高。反之,就越容易发生排斥反应,对患者术后的生存产生致命的危害。
配型为什么困难
对于干细胞移植来说,简单来说就是要将供者健康的、正常的干细胞移植到病人体内,来替换病人因疾病丧失功能的病态的、异常的细胞。
比如公众广知的脐带血造血干细胞移植,或骨髓造血干细胞移植,就是先通过手术或放化疗的处理将体内原有的病态细胞杀死,再将供者的健康细胞移植入患者体内。
这个过程中,一旦发生排斥反应,由于受者本身的免疫系统通常极为脆弱,极易造成严重后果,引发患者死亡。
因此,在移植上,通常要求6个位点至少有4个相合。对于亲属来说,患者必然从父亲和母亲钟各获得一条染色体,因而与父母的 HLA 为半相合(6个位点中3个匹配)。
而对于兄弟姐妹,根据排列组合有4种情况,与患者有HLA完全一致的可能性为1/4,因此在进行移植时,通常首选在同胞兄妹中找寻供者(见图示)。
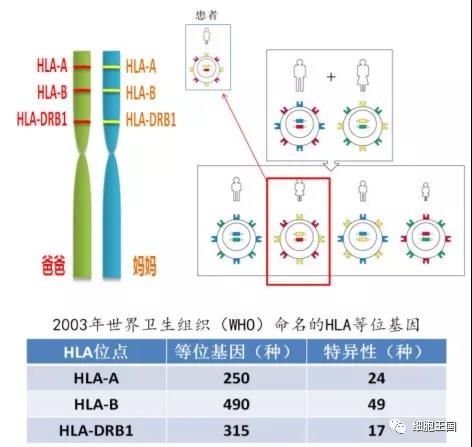
而对于无关供者来说,每一种抗原相应的等位基因有上百种,对应的特异性产物各自有数十种,如此复杂的基因及产物,可随机组合成一个巨大的数字,因此在随机人群中,难以有完全相同的 HLA。
这也就造就了我们说的“配型成功异常不易”。此外 HLA 的基因分布还有一定的民族、地域特点,所以,临床上很少见到白种人或黑种人与黄种人配型成功,这也使得跨国移植的情况显得非常稀缺。
正是这些等位基因的繁杂种类、位点相合的严格要求,使得干细胞移植的配型变得困难无比。
胎盘/脐带间充质干细胞为什么无需配型
胎盘、脐带间充质干细胞,主要指从新生儿胎盘或脐带组织中提取的一种叫做间充质干细胞(Mesenchymal Stem Cell,MSC)的细胞。
这类细胞的 HLA 抗原分子表达比较特殊,II 类分子不表达(如 HLA-DRB1),I 类分子低表达。
此外还有其它一些免疫相关分子不表达或低表达,这使得间充质干细胞可以逃避机体免疫系统的识别,避开宿主监视,因而输注到体内不会引发很强的排斥反应。因此,在临床上,使用无需进行配型。
此外,胎盘和脐带在发育上非常原始,其来源的间充质干细胞具有很强的免疫调节作用,可以抑制机体亢进的免疫反应,从而防止过度免疫应答可能对宿主组织造成的损伤。
临床上目前已有应用脐带来源的间充质干细胞联合 HLA 半相合的造血干细胞进行共移植,来治疗重型再生障碍性贫血,结果发现可以明显降低并发症的发病率,加快造血重建,且降低 GVHD(移植物抗宿主病)发生的风险,提高了移植存活率。这对于扩大造血干细胞移植供者范围,有着重大意义。
综上所述,胎盘和脐带间充质干细胞因其低免疫原性不免疫调节功能,突破了脐血或骨髓来源的造血干细胞在移植时因配型要求严格而对供者来源的限制,使得其在临床使用上无需进行配型。
而间充质干细胞可以向肌腱、血管、神经、脂肪、骨骼等多种组织分化,使其成为再生医学、组织器官损伤退行性疾病治疗领域的研究热点。人们相信,胎盘和脐带干细胞,随着未来研究的深入和医疗技术的发展,应用前景将更为广阔。